Modificaciones en las recetas medicas
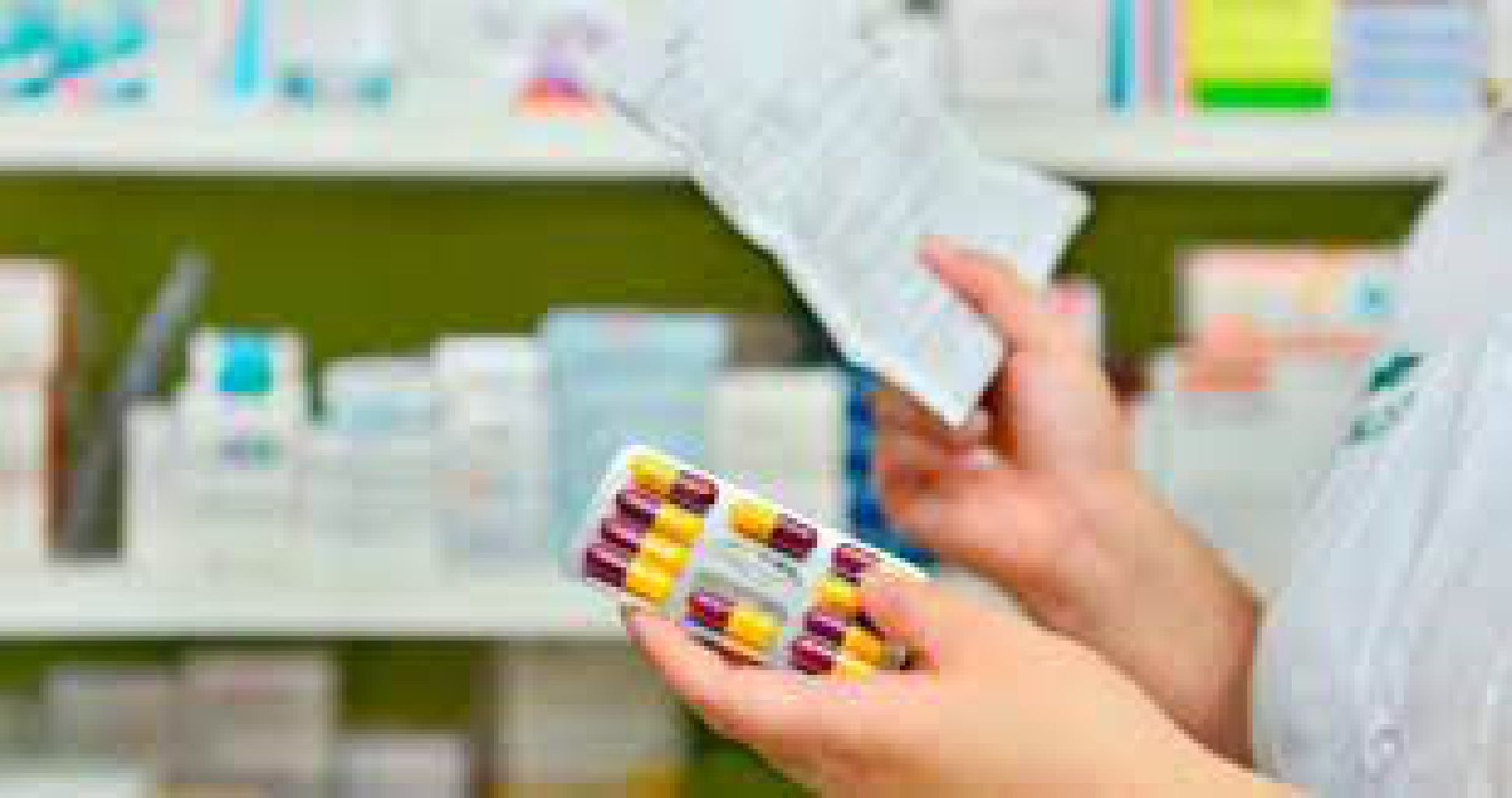
Los médicos ahora deberán consignar el nombre genérico o la denominación común internacional en las recetas, aunque también podrán sugerir una marca comercial. En este caso, el farmacéutico podrá sustituirla por otra de menor precio a pedido del consumidor. Esta medida fue establecida por el Gobierno Nacional mediante un decreto publicado en el Boletín Oficial, que también limita la venta libre de medicamentos en establecimientos no habilitados como farmacias a antiácidos y analgésicos.
El decreto 63/2024, publicado el lunes 22 del presente mes, avanza en la reglamentación de artículos relacionados con la prescripción de medicamentos y su comercialización, conforme al DNU 70/2023 firmado en diciembre pasado.
Según el Ministerio de Salud, la nueva norma busca “definir los alcances del primer decreto reglamentario, estableciendo medidas complementarias y aclaratorias para su mejor aplicación, garantizando las condiciones de seguridad sanitaria”.
Las medidas incluyen el principio de facilitar la utilización de medicamentos genéricos, estableciendo condiciones que permiten a los profesionales prescribir especialidades medicinales a través de un sistema electrónico. También se regulan las condiciones para la comercialización de medicamentos de venta libre fuera de farmacias y el despacho de recetas por parte de droguerías habilitadas.
Fuentes de la cartera sanitaria señalaron que se ha trabajado en conjunto con distintos sectores para definir las especificaciones sobre la prescripción y comercialización de medicamentos, buscando así mejorar el acceso y la seguridad en la atención médica.
Prescripción y Venta de Medicamentos: Nuevo Decreto
Según el nuevo decreto, los profesionales de la salud autorizados a prescribir medicamentos deberán incluir el nombre genérico o la denominación común internacional en las recetas. También podrán sugerir una marca comercial, y el farmacéutico estará obligado, a pedido del consumidor, a sustituir dicha marca por una especialidad medicinal de menor precio que contenga los mismos principios activos, concentración, forma farmacéutica y cantidad similar de unidades.
La norma establece que “el farmacéutico, debidamente autorizado por la autoridad competente, es el único responsable y capacitado para la debida dispensa de especialidades medicinales que requieren recetas, así como para su sustitución”. Además, se implementará un sistema de receta electrónica que devolverá al profesional información sobre cualquier sustitución realizada en la farmacia, asegurando un adecuado seguimiento del tratamiento
Expendion de Medicamentos en Establecimientos No Habilitados
El nuevo decreto también aclara que la venta de medicamentos en establecimientos que no sean farmacias estará limitada a antiácidos y analgésicos. Para obtener la autorización de la autoridad sanitaria correspondiente, estos establecimientos deberán presentar:
– Documentación: Que acredite su derecho sobre el inmueble, conforme a la legislación vigente.
– Póliza de seguro: Que cubra riesgos de venta de productos farmacéuticos por un monto mínimo equivalente a 750 salarios mínimos, vitales y móviles.
– Espacio de almacenamiento: Debe ser independiente de otros productos, cerrado con llave, y cumplir con condiciones de higiene, seguridad, limpieza, amplitud, luz y ventilación adecuadas.
Además, los medicamentos de venta libre en estos establecimientos no deben ser accesibles directamente al público y deben ser entregados por un dependiente, manteniéndose fuera del alcance de los niños. La temperatura máxima del establecimiento no podrá superar los 24 grados centígrados.
Prohibiciones y Regulaciones
El decreto prohíbe la venta de especialidades medicinales a menores de 18 años y el fraccionamiento de envases primarios y secundarios en todos los casos. La autoridad competente podrá establecer otros requisitos para garantizar que las especialidades medicinales conserven sus propiedades fisicoquímicas.
En cuanto a las droguerías, podrán despachar solo recetas que incluyan medicamentos oncológicos o tratamientos especiales listados por la autoridad de aplicación, excluyendo la venta de cualquier otra especialidad medicinal.
Incorporación de Nuevos Ingredientes
Finalmente, el decreto señala que la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat) podrá incorporar otros ingredientes farmacéuticos activos (IFA), tanto como monodroga como en asociaciones o combinaciones a dosis fija, para la realización de estudios de bioequivalencia y biodisponibilidad. También se podrán establecer excepciones basadas en evidencia científica y recomendaciones de la Organización Mundial de la Salud (OMS) y la Organización Panamericana de la Salud (OPS).
Este conjunto de regulaciones busca mejorar la seguridad y la accesibilidad de los medicamentos, garantizando al mismo tiempo el seguimiento adecuado de los tratamientos médicos.